Szybkie wdrażanie projektów cytometrów przepływowych przy użyciu modułów do akwizycji danych o wysokiej dokładności
Przekazane przez: Północnoamerykańscy redaktorzy DigiKey
2022-04-21
Cytometria przepływowa jest szeroko stosowana przez lekarzy i diagnostów do analizy charakterystyki komórek. Cytometry pozwalają na optyczną ewaluację m.in. poziomu białka, stanu krwi, ziarnistości i rozmiaru - komórka po komórce. Mimo że są to bardzo czułe systemy, na ich projektantów wywiera się ciągły nacisk, aby skracać czas analizy, co wymaga wdrożenia nowych podejść zarówno do cytometrii przepływowej, jak i związanej z nią elektroniki.
Cytometry poddają pojedyncze komórki działaniu światła laserowego w celu uzyskania sygnałów rozproszonych i fluorescencyjnych. Aby szybko i dokładnie zarejestrować wynikowe światło i przekształcić je na sygnały cyfrowe, potrzebna jest fotodioda lawinowa (APD) i złożona elektronika. Projektowanie i wdrażanie obwodów do tego procesu może trwać długo, szczególnie ze względu na to, że systemy akwizycji danych w cytometrii przepływowej wymagają szybkich urządzeń o niskim poziomie szumów, aby zapewnić dokładność układu.
Aby w ekonomiczny sposób osiągnąć szybszą analizę w procesie cytometrii przepływowej, projektanci mogą rozwiązać problemy z szybkością i dokładnością akwizycji danych wykorzystując sterowniki wewnętrznego wzmacniacza i przetwornik analogowo-cyfrowy (ADC).
W niniejszym artykule przedstawiono pokrótce działanie systemów cytometrii przepływowej. Dodatkowo zaprezentowano 18-bitowy moduł przetwornika analogowo-cyfrowego (ADC) ADAQ23878 firmy Analog Devices oraz przedstawiono sposób jego wykorzystania przy projektowaniu stopnia detekcji i konwersji w cytometrze przepływowym. Opisano również odpowiedni zestaw ewaluacyjny.
Zasady nowoczesnej cytometrii przepływowej
Nowoczesna cytometria przepływowa to zautomatyzowany proces, który analizuje komórki i molekuły powierzchniowe oraz pozwala scharakteryzować i zdefiniować różne typy komórek w niejednorodnej populacji. Jeśli nie liczyć czasu przygotowania, który może przekraczać godzinę, przyrząd przeprowadza od trzech do sześciu ocen charakterystyki 10 tys. pojedynczych komórek w czasie krótszym niż minuta.
Jest to możliwe dzięki krytycznemu etapowi cytometrii przepływowej polegającemu na przygotowaniu pojedynczych komórek. Próbki są porządkowane w płynie osłonowym, co powoduje skupienie komórek lub cząstek do postaci wąskiego strumienia pojedynczych komórek stanowiącego próbkę do analizy. Dzięki tej transformacji pojedyncze komórki muszą zachować swoje naturalne właściwości biologiczne i skład biochemiczny.
Ilustracja 1 przedstawia schemat urządzenia do cytometrii przepływowej. U góry ukazano próbkę zawierającą wiele komórek.
 Ilustracja 1: schemat procesu cytometrii przepływowej, od skupienia komórek w płynie osłonowym do akwizycji danych. (Źródło ilustracji: Wikipedia, zmodyfikowana przez Bonnie Baker)
Ilustracja 1: schemat procesu cytometrii przepływowej, od skupienia komórek w płynie osłonowym do akwizycji danych. (Źródło ilustracji: Wikipedia, zmodyfikowana przez Bonnie Baker)
Sześć głównych komponentów cytometru przepływowego to: komora przepływowa, laser, fotodioda lawinowa (APD), wzmacniacz transimpedancyjny (TIA), przetwornik analogowo-cyfrowy (ADC) oraz komputer do gromadzenia i analizy danych.
W cytometrze przepływowym znajduje się płynny strumień czy też płyn osłonowy, który jest zawężany w celu transportu i odpowiedniego ustawienia komórek w pojedynczy rząd w momencie ich przechodzenia przez wiązkę światła. Światło lasera pada w danej chwili na jedną komórkę, tworząc sygnał światła rozproszonego do przodu (FSC) i sygnał światła rozproszonego na boki (SSC). Światło fluorescencyjne jest wyodrębniane przy użyciu luster i filtrów, a następnie wzmacniane przez fotodiodę lawinową (APD).
Następnym etapem jest wykrycie, digitalizacja i analiza wynikowego strumienia świetlnego po jego dotarciu do fotodiody lawinowej. Na potrzeby wykrywania, do realizacji szybkiego wzmacniacza transimpedancyjnego (TIA) idealnie sprawdzi się wzmacniacz operacyjny LTC6268firmy Analog Devices o częstotliwości 500MHz, ultraniskim prądzie polaryzacji i niskim poziomie szumów, posiadający wejście FET.
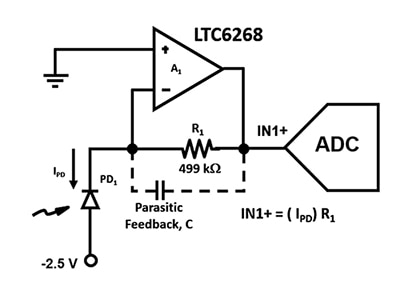 Ilustracja 2: obwód wzmacniacza transimpedancyjnego (TIA) wykorzystującego fotodiodę lawinową (PD1) i wzmacniacz FET o niskim natężeniu prądu wejściowego do przekształcenia prądu fotodiody o bardzo niskim natężeniu na napięcie wyjściowe w punkcie IN1+. (Źródło ilustracji: Bonnie Baker)
Ilustracja 2: obwód wzmacniacza transimpedancyjnego (TIA) wykorzystującego fotodiodę lawinową (PD1) i wzmacniacz FET o niskim natężeniu prądu wejściowego do przekształcenia prądu fotodiody o bardzo niskim natężeniu na napięcie wyjściowe w punkcie IN1+. (Źródło ilustracji: Bonnie Baker)
Istotne jest zaprojektowanie układu wzmacniacza o jak największej szerokości pasma, co wymaga minimalizacji pojemności pasożytniczych. Na przykład pojemność pasożytnicza sprzężenia zwrotnego C, wpływa na stabilność i szerokość pasma obwodu z ilustracji 2. Niezależnie od wyboru obudowy rezystorów, w ścieżce sprzężenia zwrotnego wzmacniacza zawsze będzie występować pojemność pasożytnicza. Jednak w przypadku zastosowań wymagających dużej prędkości zaleca się stosowanie obudowy 0805, którą charakteryzuje większa odległość między kołpakami końcowymi i mniejsza pojemność pasożytnicza.
Zwiększenie odległości między kołpakami końcowymi R1 nie jest jedynym sposobem na zmniejszenie pojemności. Innym sposobem ograniczenia pojemności pomiędzy płytami jest ekranowanie powodujących powstawanie pojemności pasożytniczej ścieżek pola E poprzez umieszczenie dodatkowej ścieżki masowej pod rezystorem R1 (ilustracja 3).
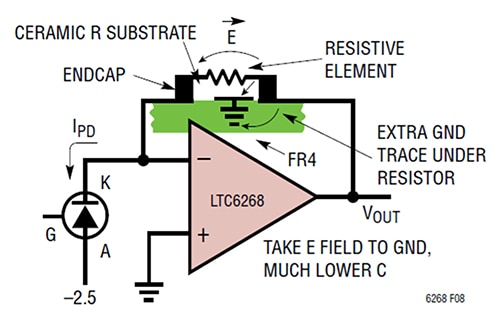 Ilustracja 3: dodanie ścieżki masowej pod rezystorem sprzężenia zwrotnego powoduje odsunięcie pola E od strony sprzężenia zwrotnego i połączenie go z masą. (Źródło ilustracji: Analog Devices)
Ilustracja 3: dodanie ścieżki masowej pod rezystorem sprzężenia zwrotnego powoduje odsunięcie pola E od strony sprzężenia zwrotnego i połączenie go z masą. (Źródło ilustracji: Analog Devices)
W tym przypadku opisywany sposób polega w szczególności na umieszczeniu krótkiej ścieżki masowej pod i pomiędzy polami rezystorów w pobliżu wyjścia wzmacniacza transimpedancyjnego (TIA). Ta technika pozwala uzyskać wartość pojemności pasożytniczej 0,028pF i szerokość pasma wzmacniacza transimpedancyjnego 1/(2π*RF*CPARASITIC), co odpowiada częstotliwości 11,4MHz.
Optyczne sygnały świetlne kierowane są do kilku diod lawinowych wyposażonych w odpowiednie filtry optyczne. Układ fotodiod (APD), wzmacniacza transimpedancyjnego (TIA) i przetwornika analogowo-cyfrowego (ADC) konwertuje te sygnały na postać cyfrową i przesyła dane do mikroprocesora do dalszej analizy.
Nowoczesne przyrządy zazwyczaj wyposażone są w wiele laserów i fotodiod lawinowych. Obecne urządzenia komercyjne posiadają dziesięć laserów i trzydzieści fotodiod lawinowych. Zwiększenie liczby laserów i detektorów fotopowielaczowych pozwala precyzyjnie oznaczyć populacje docelowe markerami fenotypowymi w drodze wielokrotnego oznaczania przeciwciał.
Jednak szybkość analizy zależy od precyzyjnego wyważenia takich parametrów jak:
- Prędkość płynu osłonowego
- Zdolność tworzenia rzędów jednokomórkowych w procesie skupiania hydrodynamicznego
- Średnica tunelu
- Zdolność do zachowania integralności komórki
- Parametry elektroniczne
Skupianie akustyczne komórek w procesie cytometrii przepływowej
Mimo że dodanie wielu laserów i fotodiod lawinowych przyspiesza analizę i identyfikację, to w najlepszym wypadku najnowsze, nowoczesne metody cytometrii przepływowej pojedynczych komórek mogą pozwolić gromadzić dane o maksymalnie milionie pojedynczych komórek na minutę. W wielu zastosowaniach, np. do wykrywania komórek nowotworowych krążących we krwi w liczbie zaledwie 100 komórek na mililitr, jest to za mało. W zastosowaniach klinicznych dotyczących rzadkich komórek badania regularnie wymagają analizy miliardów komórek.
Alternatywą dla procesu hydrodynamicznego przygotowywania skupionych komórek jest proces skupiania akustycznego. W tym przypadku materiał piezoelektryczny, jak na przykład tytanian cyrkonianu ołowiu (PZT), jest przymocowany do szklanej rurki kapilarnej w celu przekształcenia impulsów elektrycznych w drgania mechaniczne (ilustracja 4a). Wykorzystując PZT do wprawiania ścian bocznych szklanej rurki kapilarnej w drgania o częstotliwości rezonansowej prostokątnej komory przepływowej, układ generuje różne fale akustyczne stojące o różnej liczbie węzłów ciśnienia.
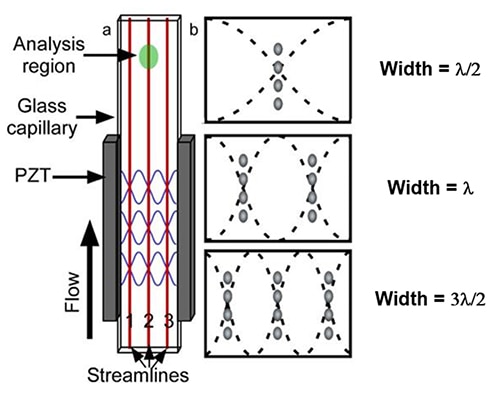 Ilustracja 4: akustyczna komora przepływowa z prostokątną szklaną rurką kapilarną (A). Lokalizacja pierwszych trzech węzłów ciśnienia dla rurki kapilarnej o stałej szerokości (b). (Źródło ilustracji: Krajowe Centrum Informacji Biotechnologicznej, NCBI)
Ilustracja 4: akustyczna komora przepływowa z prostokątną szklaną rurką kapilarną (A). Lokalizacja pierwszych trzech węzłów ciśnienia dla rurki kapilarnej o stałej szerokości (b). (Źródło ilustracji: Krajowe Centrum Informacji Biotechnologicznej, NCBI)
Wspomniane węzły częstotliwości PZT ustawiają przepływające cząstki w ciąg wielu pojedynczych cząstek (ilustracja 4b). Akustyczna komora przepływowa wykorzystuje liniową, stojącą falę akustyczną do uzyskania fal dźwiękowych o różnych długościach poprzez generowanie jednej lub wielu harmonicznych. Zgodnie z prognozą według prostego liniowego modelu fali stojącej, komórki w próbce tworzą rząd lub rzędy jednokomórkowe w komorze przepływowej.
Dzięki tak precyzyjnej organizacji komórek tunel przepływowy z osłoną może zostać poszerzony, aby umożliwić większe natężenie przepływu przez wiązkę lasera (ilustracja 5).
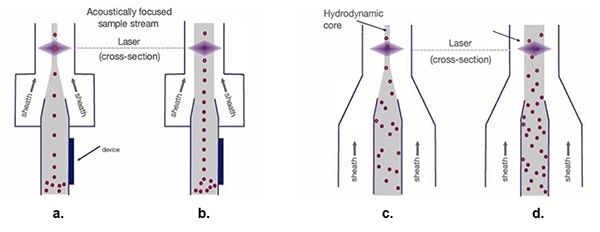 Ilustracja 5: przy hydrodynamicznym strumieniu próbki (c. i d.), wraz z poszerzeniem osłony, próbki komórek się rozpraszają, co utrudnia proces pomiaru optycznego. Akustycznie skupione strumienie próbek (a. i b.) utrzymują szyk jednokomórkowy niezależnie od szerokości osłony. (Źródło ilustracji: Thermo Fischer Scientific)
Ilustracja 5: przy hydrodynamicznym strumieniu próbki (c. i d.), wraz z poszerzeniem osłony, próbki komórek się rozpraszają, co utrudnia proces pomiaru optycznego. Akustycznie skupione strumienie próbek (a. i b.) utrzymują szyk jednokomórkowy niezależnie od szerokości osłony. (Źródło ilustracji: Thermo Fischer Scientific)
Tradycyjne skupianie hydrodynamiczne (ilustracja 5c) tworzy linie pojedynczych komórek, przygotowując je do skanowania laserowego. Szerszy lejek dla rdzenia strumienia próbki pozwala na większą prędkość materiału osłonowego (ilustracja 5d), jednak powoduje również rozpraszanie szyku jednokomórkowego, a w rezultacie zmienność sygnału i pogorszenie jakości danych.
Skupianie akustyczne (ilustracja 5a) ustawia komórki biologiczne i inne cząstki w zwartym układzie, nawet w przypadku szerszego tunelu. Takie precyzyjne ułożenie komórek pozwala na uzyskanie wyższych częstotliwości próbkowania przy zachowaniu dobrej jakości danych (ilustracja 5b).
W praktyce skupianie akustyczne w cytometrii przepływowej zwiększa częstotliwość próbkowania komórek 20-krotnie (ilustracja 6).
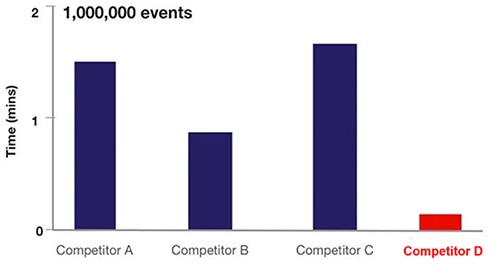 Ilustracja 6: porównanie czasu próbkowania dla różnych urządzeń do cytometrii przepływowej w oparciu o cytometrię z przepływem płynu (A, B, C) i cytometrię ze skupianiem akustycznym (D). (Źródło ilustracji: Thermo Fischer Scientific)
Ilustracja 6: porównanie czasu próbkowania dla różnych urządzeń do cytometrii przepływowej w oparciu o cytometrię z przepływem płynu (A, B, C) i cytometrię ze skupianiem akustycznym (D). (Źródło ilustracji: Thermo Fischer Scientific)
Na ilustracji 6 urządzenia z A, B i C wykorzystują technologię hydrodynamiczną, podczas gdy urządzenie z D wykorzystuje przepływową metodę skupiania akustycznego w procesie cytometrii.
Akwizycja danych w cytometrii przepływowej ze skupianiem akustycznym
Projektowanie elektroniki do urządzeń do cytometrii przepływowej ze skupianiem akustycznym wymaga zastosowania szybkiej elektroniki fotodetekcyjnej, aby uwzględnić prędkość komórek krwi i przepływ płynu osłonowego przez dyszę o większej średnicy. Wspomniany wcześniej wzmacniacz operacyjny LTC6268 600MHz w połączeniu ze specjalną obudową rezystora 0805 zapewnia optyczną częstotliwość pomiaru dochodzącą do 11,4MHz (ilustracja 7, po lewej stronie). Sygnał wyjściowy wzmacniacza operacyjnego LTC6268 dociera do przetwornika analogowo-cyfrowego ADAQ23878 firmy Analog Devices, gdzie poddawany jest digitalizacji.
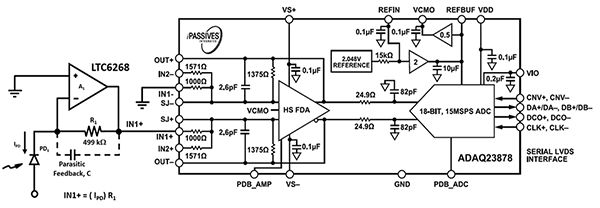 Ilustracja 7: przetwornik analogowo-cyfrowy ADAQ23878 digitalizuje sygnał optyczny z fotodiody (PD1) i obwodu wzmacniacza transimpedancyjnego (po lewej). (Źródło ilustracji: Bonnie Baker)
Ilustracja 7: przetwornik analogowo-cyfrowy ADAQ23878 digitalizuje sygnał optyczny z fotodiody (PD1) i obwodu wzmacniacza transimpedancyjnego (po lewej). (Źródło ilustracji: Bonnie Baker)
Przetwornik ADAQ23878 jest 18-bitowym, precyzyjnym, szybkim rozwiązaniem do gromadzenia danych w układzie SiP o częstotliwości próbkowania 15MSPS. Skraca on znacznie cykl rozwojowy precyzyjnych układów pomiarowych poprzez przeniesienie obciążenia projektowego związanego z doborem wejściowych komponentów sterujących, optymalizacją i układem z projektanta na urządzenie.
Podejście modułowe SIP zmniejsza liczbę komponentów w systemie końcowym, łącząc wiele bloków przetwarzania i kondycjonowania sygnałów trybu współbieżnego w jednym urządzeniu oraz szybki 18-bitowy przetwornik analogowo-cyfrowy o sukcesywnej aproksymacji (SAR ADC) i częstotliwości próbkowania 15MSPS. Bloki te obejmują w pełni różnicowy wzmacniacz sterujący przetwornika analogowo-cyfrowego (ADC) o niskim poziomie szumów oraz stabilny bufor referencyjny.
W przetworniku analogowo-cyfrowym ADAQ23878 zastosowano również najważniejsze komponenty pasywne wykorzystujące technologię iPassive firmy Analog Devices w celu zminimalizowania źródeł błędów zależnych od temperatury i optymalizacji parametrów pracy. Stopień sterownika szybko uzyskujący stan ustalony stanowiący część przetwornika analogowo-cyfrowego (ADC) przyczynia się do jego zdolności do szybkiej akwizycji danych.
Ewaluacja mikromodułu µModule ADAQ23878
Na potrzeby ewaluacji modułu ADAQ23878 firma Analog Devices przygotowała płytkę ewaluacyjną EVAL-ADAQ23878FMCZ (ilustracja 8). Płytka demonstruje działanie mikromodułu μModule ADAQ23878 i stanowi uniwersalne narzędzie do ewaluacji projektu układu front-end do cytometrii przepływowej oraz wielu innych zastosowań.
 Ilustracja 8: płytka ewaluacyjna EVAL-ADAQ23878FMCZ do modułu ADAQ23878 zawiera obwody zasilania, jest wyposażona w odpowiednie oprogramowanie do sterowania i analizy danych oraz jest zgodna z płytką SDP-H1. (Źródło ilustracji: Analog Devices)
Ilustracja 8: płytka ewaluacyjna EVAL-ADAQ23878FMCZ do modułu ADAQ23878 zawiera obwody zasilania, jest wyposażona w odpowiednie oprogramowanie do sterowania i analizy danych oraz jest zgodna z płytką SDP-H1. (Źródło ilustracji: Analog Devices)
Płytka ewaluacyjna EVAL-ADAQ23878FMCZ wymaga komputera osobistego z systemem Windows 10 lub nowszym, niskoszumowego precyzyjnego źródła sygnału i filtra pasmowo-przepustowego odpowiedniego do testowania 18-bitowego. Płytka ewaluacyjna wymaga wtyczki ACE ADAQ23878 i sterownika SPD-H1.
Podsumowanie
Badania pojedynczych komórek biologicznych przy użyciu standardowych technik cytometrii przepływowej ze skupianiem hydrodynamicznym są z powodzeniem realizowane, ale w związku z koniecznością zapewnienia szybszej analizy zaczęto korzystać z technik opartych na metodach przepływowych ze skupianiem akustycznym. Jednak elektronika obsługująca bardziej zaawansowaną cytometrię przepływową musi również być coraz lepsza, przy jednoczesnym zminimalizowaniu przestrzeni, kosztów i skróceniu czasu prac rozwojowych.
W celu uzyskania kompletnego układu akwizycji danych do zaawansowanych urządzeń do cytometrii przepływowej można połączyć szybki wzmacniacz operacyjny LTC6268 z precyzyjnym, szybkim mikromodułem μModule ADAQ233878 do akwizycji danych.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.







